2006年の誘導多能性幹(iPS)細胞の開発に端を発した細胞系譜を人為的に操作する「リプログラミング」技術は、基礎生物学と再生医療における革新的技術として進展してきた。しかし、依然としてリプログラミングの効率とリプログラミング後の分化能などの「細胞の質」が低いことが問題となっている。
その原因として、
転写因子であるリプログラミング因子の根本的な分子基盤が未だ十分に解明されていないことが挙げられる。
当チームリーダーは、多能性ならびにリプログラミング機構に重要な転写因子であるNANOGのホメオドメイン-DNA複合体の結晶構造を得ることに成功し、その構造からDNAと直接相互作用するアミノ酸残基を同定した。それらの各アミノ酸残基をアラニンに置換した変異体を作製し、それぞれ精製したタンパク質ならびにES細胞等を用いた機能解析を実施した。その結果、各アミノ酸残基のDNA結合における役割を解明するとともに、野生型NANOGよりDNA結合能ならびに複合体の安定性が高く、よりリプログラミング能の高い改良型変異体の開発に成功した (Hayashi et al., PNAS 2015)。
今後はさらにiPS細胞へリプログラミングするのに必須である「リプログラミング因子」の分子基盤の機能解析を実施し、その構造と機能の知見から、野生型タンパク質よりも優れたリプログラミング能を持つ「人工リプログラミング因子」の開発を目指す。
研究例
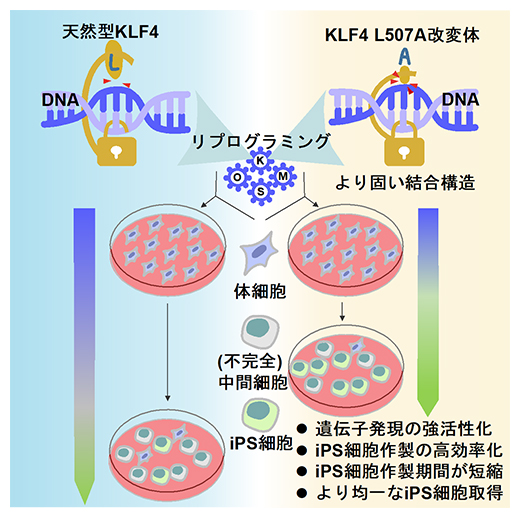
次世代リプログラミング因子KLF4改変体の開発
-iPS細胞をより高効率・高品質に作製-
今回、共同研究グループは、iPS細胞作製の際に必要なリプログラミング因子の一つであるKLF4タンパク質において、DNAと直接相互作用するアミノ酸残基の改変体を多数作製した。その中から「KLF4 L507A改変体(ヒトKLF4の507番目のアミノ酸残基ロイシンをアラニンに置換したもの)」を用いてiPS細胞を作製したところ、迅速、かつ高効率で、高品質なiPS細胞株を樹立できることが分かった (Borisova et al., iScience)。