当チームリーダーはこれまで、
環状染色体 (Bershteyn*, Hayashi* et al., Nature 2014: *equally contributed)、進行性骨化性線維異形成症 (Hayashi et al PNAS 2016; Matsumoto*, Hayashi* et al., OJRD 2013)、QT延長症候群 (Spencer et al., Stem Cell Reports 2014)などを対象として、疾患特異的iPS細胞を用いた難病、創薬研究に携わってきた。
引き続き当チームにおいても、
理研BRC細胞材料開発室が細胞バンク事業として提供している疾患特異的iPS細胞を用いて、以下の難病・創薬研究を推進する。
- 疾患標的細胞の分化誘導法が確立されていない場合には、分化誘導法の開発を実施する。
- 培養条件下において疾患を再現可能な細胞レベルでの異常表現型を同定する。
この同定は、iPS細胞からの分化細胞種において、
疾患特異的iPS細胞と健常人由来iPS細胞(あるいはisogenic control cells)の結果と比較することで見出す。 - 上記の比較解析系を確立したのちには、
疾患特異的iPS細胞での異常表現型をもたらす原因遺伝子の解析、
および異常表現型を修復させる化合物探索を実施する。 - iPS細胞を用いた新規の再生医療を創出する(Proof-of-Concept)
研究例
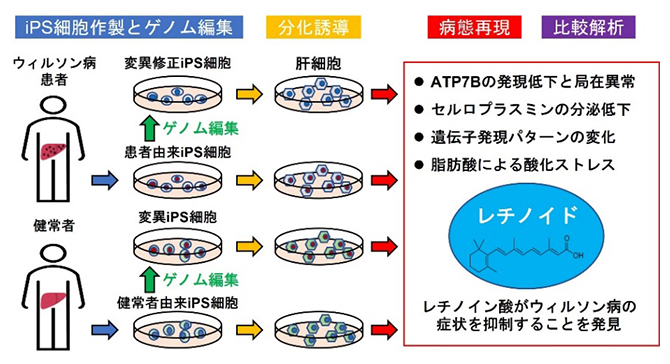
患者由来iPS細胞の肝臓難病モデル
-ウィルソン病の治療薬候補を探索-
ウィルソン病はATP7B遺伝子の変異によって起こり、体内に不要な銅が蓄積するために、肝臓や脳などを中心に全身性の障害が生じる疾患です。本研究成果は、ウィルソン病や肝機能障害の新たな治療法開発につながると期待できます。
今回、共同研究グループは、患者から樹立したiPS細胞を肝細胞に分化させることで、ウィルソン病の病態を培養皿中で再現しました。さらに、ゲノム編集を用いて、ATP7B遺伝子の変異を正常な配列へと修正したり、逆にATP7B遺伝子を変異させたりすることで、ATP7B遺伝子の詳細な機能解析を可能にしました。これらのiPS細胞に由来する肝細胞において、レチノイドという物質がウィルソン病の症状を抑制することも見いだしました (Song et al., Human Molecular Genetics 2022)。